II. Stickstoffassimilation und die
Symbiose mit Knöllchenbakterien
R. Marquard
Die Luft der Atmosphäre enthält etwa 78 % Stickstoff und stellt damit, verglichen mit dem Kohlendioxydgehalt von nur 0,03 %, ein unerschöpfliches Reservoir an diesem Element dar. Alle Lebewesen benötigen Stickstoff als essentiellen Baustein für Nucleinsäuren und Proteine - allerdings können nur wenige ihren Bedarf aus dem Luftstickstoff decken. Auch höhere Pflanzen, die dazu prädestiniert sind, Elemente oder anorganische Verbindungen in ihrem Stoffwechsel zu inkorporieren und in organische Strukturen einzubauen, haben keinen direkten Zugriff auf den atmosphärischen Stickstoffvorrat, da Eukaryonten nicht in der Lage sind, den als N2 molekular vorliegenden Luftstickstoff zu assimilieren.
Daß Leguminosen schon in den Anfängen der Agrikulturchemie als "Stickstoffsammler" erkannt wurden und somit eine Sonderstellung unter den landwirtschaftlichen Kulturpflanzen einnehmen, resultiert aus ihrer Symbiose mit sogenannten Knöllchenbakterien (Rhizobien), die als Prokaryonten eine für die N2-Bindung erforderliche Enzymausstattung besitzen. Die Symbiose beruht auf der Basis, daß die Wirtspflanze (Leguminose) den Symbionten (Bakterium) mit Energie und Kohlenstoffassimilaten versorgt, der Symbiont liefert etwa 90 % des von ihm assimilierten Luftstickstoffes an die Wirtspflanze.
Umfang der Symbiose
Die Zahl der Leguminosenarten wird in der Literatur mit etwa 17.000 angegeben, von denen bisher nur etwa 10 % hinsichtlich ihrer Symbiose mit Rhizobium-Arten untersucht sind.
Bekannt ist, daß mehr als 90 % der Arten Wurzelknöllchen ausbilden (Nodulation), unter denen die Weltwirtschaftspflanzen wie Sojabohne (Glycine max), Erdnuß (Arachis hypogaea), Erbse (Pisum sativum) und Ackerbohne (Vicia faba) am besten erforscht sind.
Die Entwicklung der Symbiose wird heute als Signalkette verstanden, in der offenbar Lectine (Proteine, die in der Zellwand oder im Plasmalemma der Wirtszelle lokalisiert sind) eine besondere Rolle spielen. Lectine haben die Eigenschaft der selektiven Bindung von Polysacchariden (Mehrfachzucker), die sich auf der Oberfläche des Bakteriums befinden; sie leiten damit die Signalkette ein, die nach WERNER in den Schritten Signalaufnahme, Signalumwandlung und Signalverarbeitung abläuft.
Als biochemischer Mechanismus im Ablauf der Erkennungsphase bzw. Signalaufnahme wird, wie bereits erwähnt, die Lectinhypothese diskutiert, in der eine Wechselwirkung zwischen Lectinen der Wirtspflanze sowie Exo- und Lipopolysacchariden der Symbionten angenommen wird.
Die Signalaufnahme beinhaltet die Erkennung von Wirtspflanze und Symbiont und die frühen Stadien der Infektion bis zur Vermehrung oder Abtötung des Bakteriums.
In der Literatur gibt es indes Befunde, die sowohl für als auch gegen diese Hypothese sprechen. Gründe für die abweichenden Ergebnisse mögen einerseits in nicht vergleichbaren Experimenten liegen, aber auch darin, daß in Extrakten aus Geweben der Wirtspflanzen außer Lectinen und Polysacchariden eine Reihe weiterer, teils undefinierter, Komponenten nachgewiesen wurden, die physiologische Reaktionen bei Wirt und Symbiont auslösen.Freilebende Zellen von Rhizobium/Bradyrhizobiumò Erkennung der Wurzelhaare der Wirtspflanze
ò Einkrümmung der Wurzelhaare mit Einschluß des Bakteriums
ò Selektive Wurzelhaarinfektion
ò Ausbildung des Infektionsschlauches durch Einstülpung der Zellwand ò Wachstum des Infektionsschlauches mit Durchdringung der Zellwand der Wurzelhaarzelle und des Rindengewebes
ò Infektionsschlauch erreicht das Cytoplasma der Rindenzellen
ò Einwanderung der Bakterien in das Cytoplasma der Rindenzellenò Vermehrung oder Abtötung der Bakterien
Eine besondere Bedeutung für die Interaktion zwischen Wirtspflanze und Symbiont kommt offenbar den Wurzelhaaren der Leguminosen zu, über deren Biochemie und Physiologie bisher nur lückenhafte Erkenntnisse vorliegen.
Die Wurzelhaare verschiedener Leguminosen weichen beispielsweise in den Mineralstoffgehalten sehr deutlich von anderen Kulturpflanzen ab.
Bei Sojabohnen konnte nachgewiesen werden, daß mit Kalzium, Eisen und Kobalt jene Elemente extrem angereichert sind, für die ein hoher Bedarf bei deren symbiontischen Rhizobien besteht. Daraus wird geschlossen, daß nicht nur Kohlenstoffassimilate und Energieträger von der Wirtspflanze an die Bakterien geliefert werden, sondern daß auch die Abdeckung eines spezifischen Mineralstoffbedarfes ein Kriterium für das Funktionieren der Symbiose ist. Weiterhin konnten bei Sojabohnen und Erbsen, neben den bereits erwähnten Lectinen, weitere besonders strukturierte Proteine nachgewiesen werden, die als Signal- oder Rezeptormoleküle an der Interaktion zwischen Wirtspflanze und Symbiont funktionell beteiligt sind.
Infektion und Knöllchenbildung
Die Infektionsmechanismen sind vergleichsweise gut bei der Sojabohne untersucht, so daß die folgenden Ausführungen weitgehend an ein für diese Kulturpflanze entwickeltes Modell von TURGEON und BAUER angelehnt sind:
Eine an der Wurzeloberfläche anhaftende Rhizobien-Zelle durchdringt die Schleimschicht des Wurzelhaares und löst dadurch eine Krümmungsreaktion aus, in deren Verlauf es zu einer Anpressung der Rhizobium-Zelle an die Zellwand des Wurzelhaares oder einer Epidermiszelle kommt. An dieser Stelle wird die Zellwand aufgelöst und um das eindringende Bakterium wird ein intrazellulärer Infektionssack gebildet.
Der Infektionssack entwickelt sich unter Verzweigung
und Infektion weiterer Rindenzellen zu einem Infektionsschlauch, durch
dessen Wachstum Zellteilungen in der Wurzelrinde initiiert werden, so daß
es bereits wenige Tage nach der Inokulation zur Bildung makroskopisch erkennbarer
Knöllchen kommt.
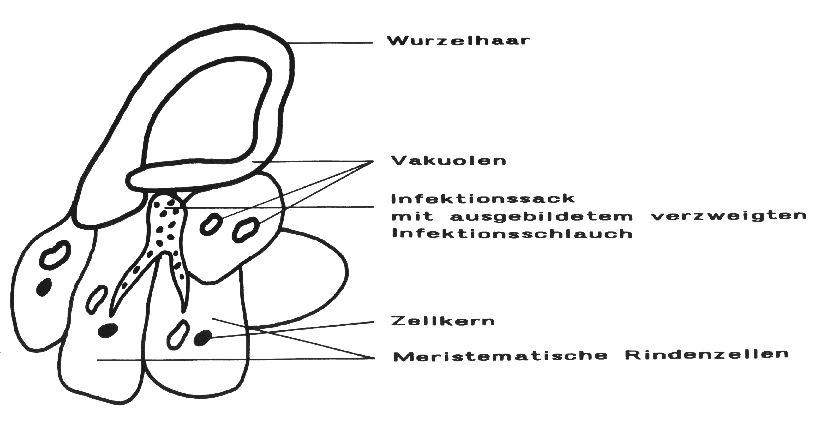
Darstellung 7: Schematische Darstellung der Entwicklung des Infektionsschlauches bei der Sojabohne (modifiziert nach WERNER)
Signalumwandlung und Signalverarbeitung führen nach Vermehrung der Bakterien in der Wirtszelle letztlich zu der Differenzierung von Bakteroiden, wobei verschiedene Gene der Wirtspflanze beteiligt sind.
Wirtsbereichsgene, Nodulationsgene, N2-Fixierungsgene, Stoffwechselgene und Strukturgene.
Der Genotyp der Wirtspflanze trägt somit entscheidend dazu bei, ob sich aus den eingewanderten Bakterien symbiontisch effektive Strukturen in Form von Bakteroiden entwickeln können.
Von besonderer Bedeutung sind hierbei Gene, die den
Phytohormonspiegel regulieren und durch die pflanzliche Abwehrmechanismen
kontrolliert werden.
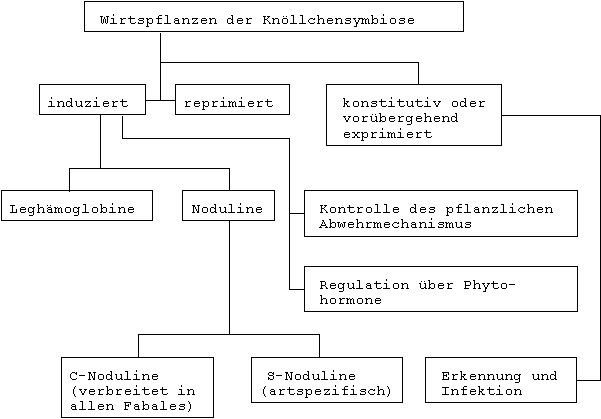
Darstellung 8: Beeinflussung von Entwicklung und Funktion der Knöllchen durch Wirtspflanzengene (nach WERNER)
Die Knöllchen der Leguminosen weisen hohe Gehalte an Auxinen, Cytokininen und Gibberellinen auf, ohne daß bisher spezifische Funktionen dieser Phytohormone an der Differenzierung der Knöllchen bekannt sind.
Bei der Signalverarbeitung werden nach WERNER folgende Schritte unterschieden:
Frühe Wurzelreaktionen
Genetisch gesteuerte Biosynthese von spezifischen Proteinen, die als Noduline bezeichnet werden
Genetisch bedingte Ausbildung von Leghämoglobinen
Auftreten pflanzlicher Glutaminsynthetasen (genetisch gesteuert)
Differenzierung der Peribakteroidmembran
Biosynthese spezifischer Proteine im Peribakteroidraum
Die Anzahl von Struktur- und Regulationsgenen, die an der Entwicklung und Funktion der Knöllchen spezifisch beteiligt sind, ist bisher noch nicht abschätzbar. Wenn man davon ausgeht, daß in der höheren Pflanze ca. 100.000 Gene vorhanden sein können, wird einsichtig, daß bei einem derart komplexen Regulationssystem eine Identifizierung nicht einfach sein kann.
In umfangreichen Untersuchungen von LARUE et al.
an der Erbse (Pisum sativum) wurden
7 Gene, die an der Knöllchenbildung (Nodulation) spezifisch beteiligt
sind, nachgewiesen. Die identifizierten Gene und ihre phänotypische
Ausprägung sind in Darstellung 9 beispielhaft wiedergegeben.
| Gen | Ausprägung im Phänotyp |
| "nod1" und "nod2" | Steuerung der Knöllchenzahl pro Pflanze |
| "nod3" | Beeinflussung der Knöllchenbildung bei höheren Nitratkonzentrationen (z.B. >15 mM) |
| "sym1" | Knöllchenbildung in Abhängigkeit von der Temperatur (z.B. keine Nodulation bei Temperaturen unter 20°C) |
| "sym2" | Bestimmung des Wirtsbereiches in Kombination mit "nod"-Genen |
| "sym3" | Bildung von ineffektiven Knöllchen im Hinblick auf die N2-Fixierung |
| "sym4" | Resistenz gegen Nodulation bei Infektion durch einen einzelnen Stamm von Rhizobium leguminosarum |
| "sym5" | Umfassende Resistenz gegen Nodulation (bei allen getesteten Stämmen von R. leguminosarum |
| "sym6" | Einschränkung der N2-Fixierung |
| "sym7" | Resistenz gegen Nodulation. Nicht allel mit "sym5" |
Die differenzierten Bakteroide erreichen etwa das 40-fache Volumen der Ausgangsbakterien und verfügen über die Enzymausstattung, die für die N2-Bindung und Assimilation erforderlich sind. Bakteroide können sich nicht weiter teilen und fungieren in der Wirtszelle als N2-fixierende Organellen. Ihre Anzahl in einer Wirtszelle liegt in der Größenordnung von 10.000 mit einem entsprechenden Potential im Hinblick auf die N2-Fixierung.
Morphologisch werden bei den Knöllchen der Leguminosen 2 Grundtypen (A und B) unterschieden, deren Aufbau in Darstellung 10 schematisch dargestellt ist.
Bei Typ A handelt es sich um eine zylindrische Form mit einem apikalen Meristem und einem verzweigten Leitbündelsystem, die im Wachstum nicht determiniert (unbegrenzt) ist. Biochemisch ist dieser Knöllchentyp durch die N-Transportform, die aus Amiden, vornehmlich Asparagin und Glutamin, besteht, charakterisiert. Außerdem wurden bei diesem Knöllchentyp Transferzellen im Perizykelgewebe nachgewiesen. Diese zylindrischen Formen kommen insbesondere bei Vicia - und Trifolium - Arten vor.Bei Typ B handelt es sich um eine kugelige Form. Sie ist durch ein geschlossenes Leitbündelsystem mit halbkreisförmigen Strängen und durch ein determiniertes (begrenztes) Wachstum charakterisiert. Die N-Transportform sind vornehmlich Harnstoffderivate, z.B. Allantoin und Allantoinsäure, die im Vergleich zu den Amiden eine geringere Wasserlöslichkeit besitzen und deshalb besser in einem geschlossenen Leitbündelsystem transportiert werden können. Diese kugelige oder sphärische Knöllchenform tritt vorzugsweise bei Glycine - und Phaseolus - Arten auf.
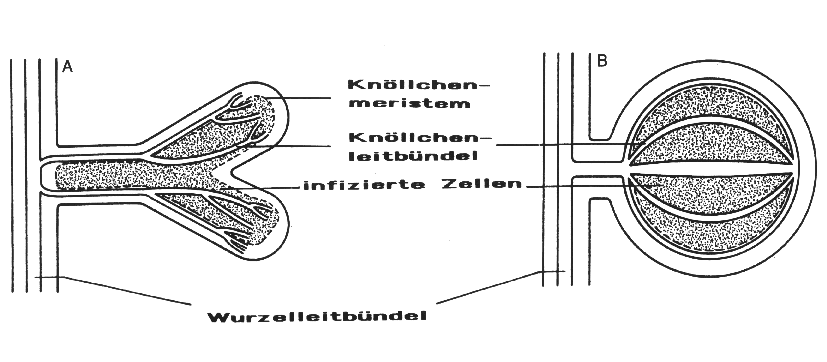
Darstellung 10: Schematisch dargestellter Aufbau der Grundtypen A und B von Leguminosen-Knöllchen (nach WERNER, verändert)
Neben diesen beiden Grundtypen kommen eine Reihe von Übergangsformen vor, die offenbar aus Modifikationen, unter dem Einfluß der Wirtspflanze und der Umwelt, resultieren.
Zur Cytologie und Ultrastruktur der Knöllchen liegen, insbesondere durch elektronenmikroskopische Untersuchungen, gleichfalls Forschungsergebnisse vor. Hierbei konnte nachgewiesen werden, daß die Symbionten (Bakteroide) von einer stabilen Peribakteroidenmembran umgeben sind. Eine stabile Peribakteroidenmembran stellt eine physiologische Barriere zwischen Mikrosymbiont und dem Cytoplasma der Wirtszelle dar, durch die verhindert wird, daß die Wirtszelle das Bakteroid als Fremdorganismus bzw. Parasit erkennt und Abwehrreaktionen auslöst. Zur Biogenese der Peribakteroidenmembran werden derzeit 2 Modelle diskutiert, die in Darstellung 11 schematisch gezeichnet sind.
In dem Modell der "Membrandifferenzierung" wird angenommen, daß Membranvesikel direkt vom Golgi-Apparat auf die wachsende Peribakteroidenmembran treffen und dort fusionieren.
Bei dem Modell des "Membranrecyclings" wird postuliert, daß die Vesikel über die Plasmamembran zur Peribakteroidenmembran transportiert werden.
Für die Funktion der Bakteroide sind diese möglichen
Unterschiede im Biogeneseweg indes ohne Bedeutung, so daß hier nicht
weiter darauf eingegangen wird.
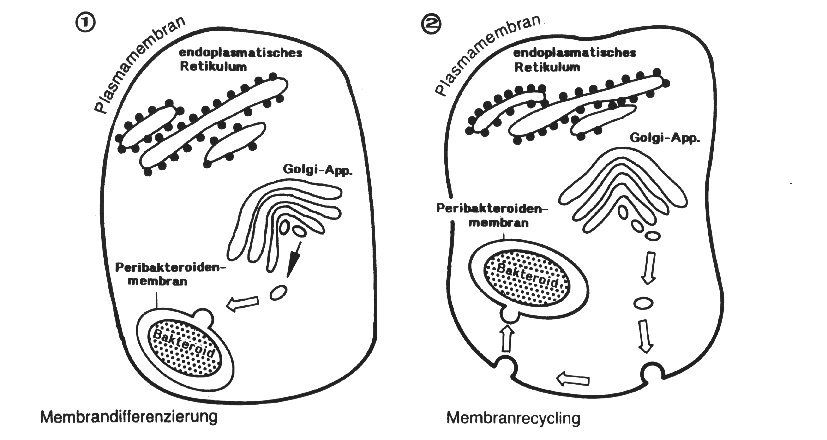
Darstellung 11: Modelle der Peribakteroidenmembran - Biogenese (nach MELLOR et al., verändert)
Biochemische Grundlage der N2-Fixierung
Der physiologisch bedeutsame Vorgang in der Symbioseentwicklung ist offenbar die Aktivierung der Nitrogenase in den Bakteroiden. Die Wirtspflanze stellt für den Stoffwechsel der Knöllchen Kohlenstoff- und Energiequellen zur Verfügung, sie liefert die Sauerstoffschutzmechanismen, um den O2-Partialdruck in den infizierten Wirtszellen der Knöllchen abzusenken sowie die Enzyme für die Ammoniumassimilation. Von den Bakteroiden wird über nachstehende Reaktion molekularer Stickstoff (N2) zu Ammoniak reduziert und über mehrere Wochen, d.h. bis zur Auflösung der Bakteroide, der Wirtspflanze zugeführt.
Allgemeine Reaktion der N2-Fixierung:
N2 + 8e- + 8H+ + 16 Mg ATP 2NH3 + H2 + 16 Mg ADP + 16Pi
Die NH3-Assimilation in der Wirtszelle bis zum Aufbau von Aminosäuren verläuft über die in Darstellung 12 aufgezeigten Reaktionswege:
Die dargestellten Reaktionen der NH3-Assimilation werden vornehmlich durch folgende Enzyme katalysiert:
Glutaminsynthetase
Glutamatsynthase
Aspartataminotransferase
Darstellung 12: Reaktionswege bei der Bildung von Aminosäuren in Wirtszellen von Leguminosen-Knöllchen (nach DILWORTH und GLENN, verändert)
Der energetische Aufwand der Pflanze für die N2-Assimilation ist im Vergleich zu der CO2-Inkorporierung beträchtlich. Für die Fixierung und Assimilation von 1 Mol N2 werden 19 ATP benötigt, während für die Assimilation von 1 Mol CO2 bei den C3-Pflanzen nur 3 ATP und bei den C4-Pflanzen 5 ATP verbraucht werden. Somit ist eine ausreichende photosynthetische Leistung der Wirtspflanze Voraussetzung für eine hohe N-Fixierungsrate.
Effektivität der N2-Bindung
Die N2-Fixierungsraten werden ganz wesentlich vom Genotyp, dem Entwicklungszustand der Wirtspflanze und den Symbionten bestimmt.
Daneben wirken sich auch zahlreiche äußere Faktoren aus, von denen nachfolgend einige herausgegriffen werden:
Von den Klimafaktoren spielt die Temperatur eine entscheidende Rolle, indem bei den Leguminosenarten und ihren Symbionten spezifische Temperaturoptima hinsichtlich der Nitrogenaseaktivität bestehen:
Z.B. Vicia sativa 20° C, Trifolium subteraneum und T. pratense zwischen 25 und 30° C. Bei Pflanzen der gemäßigten Klimate liegt die untere Grenze der N2-Fixierung bei etwa 2° C und für tropische Arten bei ca. 10° C.
Der Wassergehalt des Bodens beeinflußt die Nitrogenaseaktivität in der Regel über die Zahl der Knöllchen. Untersuchungen bei Vicia faba ergaben beispielsweise, daß unter Wassermangel die Zahl der Knöllchen bei 200 lag, bei ausreichender Wasserversorgung stieg die Zahl auf 500 an und erreichte bei einem Wasserüberschuß einen Wert von über 800. Parallel dazu stieg die Nitrogenaseaktivität pro Pflanze von 20 über 40 auf 60 µmol pro Stunde an. Allerdings wirkt sich Stauwasser, verbunden mit einem Sauerstoffdefizit, negativ auf die Nitrogenaseaktivität aus.
In der Untersuchung an Vicia faba wurde auch nachgewiesen, daß Knöllchenzahl und Nitrogenaseaktivität nicht von der Größe des Wurzelsystems abhängen, sondern mit der Sproßentwicklung bzw. der Photosyntheseleistung der Pflanze positiv korreliert sind.
Sauerstoff- und Kohlendioxidgehalte der Bodenluft wirken sich gegensinnig auf die N2-Fixierungsrate aus. Wie bereits im Zusammenhang mit dem Wassergehalt erwähnt, ist ein niedriger O2-Gehalt der Bodenluft ein stark begrenzender Faktor der N-Bindung, während höhere CO2-Konzentrationen die Knöllchenfunktion durch Begünstigung der PEP-Carboxylase-Reaktion deutlich fördern. Daraus resultiert, daß lockere, gut durchlüftete und biologisch aktive Böden die Voraussetzung für eine effektive N-Bindung sind.
Die Konzentration von Nitrat- und Ammonium-Ionen in der Bodenlösung beeinflußt gleichfalls die Knöllchenentwicklung und Effektivität der N2-Fixierung. Nitrat hemmt bereits in Konzentrationen von 3 bis 10 µmol die Knöllchenentwicklung durch Depression der Lectin-Biosynthese, der Wurzelkrümmung und Ausbildung des Infektionsschlauches.
Die negative Beeinflussung der Nitrogenaseaktivität
und der Nitratreduktion in bereits entwickelten Knöllchen verläuft
in 2 Stufen, bis zu einer totalen Hemmung der Nitrogenase. Auf die Anreicherung
von Ammonium-Ionen reagieren nodulierte Pflanzen zunächst ähnlich
wie bei dem Zusatz von Nitrat (Darst. 13), indem die Aktivität in
kurzer Zeit bis auf ca. 50 % des Ausgangswertes abfällt. Danach tritt
allerdings nur noch ein mäßiger Abfall ein.
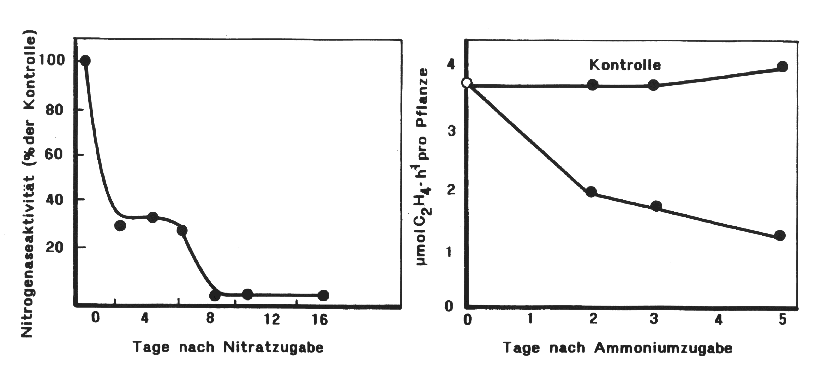
Darstellung 13: Wirkung von 10 mmol Nitrat ( bei T. repens) und 20 mmol Ammonium (bei P. sativum) auf die Nitrogenaseaktivität (nach CARROL und RESSHOFF bzw. nach WERNER, verändert)
Weiterhin hemmen Krankheiten unterschiedlicher Genese, die das Pflanzenwachstum beeinträchtigen, auch die Entwicklung der Knöllchen.
Infolge der vielfältigen Einflüsse auf
die N2-Fixierung besteht eine erhebliche Variationsbreite in der Effizienz
der verschiedenen Kulturpflanzen, wie aus Tabelle 2 zu ersehen ist.
Tabelle 2: N2-Fixierung verschiedener Leguminosenarten
in kg/ha und Jahr (nach QUISPEL, verändert)
| Kulturpflanzen | Variationsbreite | Durchschnittswerte |
| Klee |
|
|
| Luzerne |
|
|
| Ackerbohne |
|
|
| Erbse |
|
|
| Lupine |
|
|
| Sojabohne |
|
|
| Erdnuß |
|
|
| Linse |
|
|
Literatur
ATKINS, F. B., 1973: Metabolism and translocation of fixed nitrogen in nodulated legume. Plant and Soil 100, 157-169.
BURIAS, N., C. PLANCHON, & M. H. PAUL, 1990: Phenotypic and genotypic distribution of nodules on soybean root system inoculated with Bradyrhizobium japonicum strain G49. Agronomie 10, 57-62.
CALLAHAM, D. A. & J. G. TORREY, 1981: The structural basis for infection of root hairs of Trifolium repens by Rhizobium. Can. J. Bot. 59, 1647-1664.
CARROL, B. J. & P. M. GRESSHOFF, 1983: Nitrate inhibition of nodulation and nitrogen fixation in white clover. Z. Pflanzenphysiol. 110, 77-88.
DAY, D. A., B. J. CARROL, A. C. DELVES & P. M. GRESSHOFF, 1989: Relationship between autoregulation and nitrate inhibition of nodulation in soybeans. Physiol. Plant. 75, 37-42.
DILWORTH, M. & A. GLENN, 1984: How does a legume nodule work? Trends in Biological Science, 519.
EVANS, H. J. & R. H. BURRIS, 1992: Highlights in biological nitrogen fixation during the last 50 years. In: G. STACY, H. J. EVANS & R. H. BURRIS (eds.): Biological nitrogen fixation. Chapman and Hall, London.
HUNTER, W. J., 1989: Indole-3-acetic acid production by bacteroides from soybean root nodules. Physiol. Plant. 76, 31-36.
KOLB, W., 1984: Nitrogenase (C2H2)-Aktivität und Populationsdichte von Luftstickstoff-bindenen Bakterien in der Rhizosphäre in Abhängigkeit von Umweltfaktoren. Diss. Stuttgart-Hohenheim.
MARTIN, P., A. GLATZLE, W. KOLB, H. OMAY & W. SCHMIDT, 1989: N2-fixing bacteria in the rhizosphere: Qualification and hormonal effects on root development. Z. Pflanzenernährg. Bodenk. 152, 237-245.
MELLOR, R. B., C. GARBERS & D. WERNER, 1989: Peribacteroid membrane noduline gene induction by Bradyrhizobium japonicum mutants. Plant Mol. Biol. 12, 307-315.
MENGEL, K., 1984: Ernährung und Stoffwechsel der Pflanze. 6. Aufl., Verlag Gustav Fischer, Stuttgart.
NAP, J.-P. & T. BISSELING, 1990: Noduline functions and noduline gene regulations in root nodule development. In: GRESSHOFF, P. M. (ed.): Molecular Biology of Symbiotic Nitrogen Fixation. CRC Press, Boca Raton.
QUISPEL, A., 1982: Frontiers of research in symbiotic nitrogen fixation. In: ROY, S. K. (ed.): Frontiers in Research of Agriculture. Indian Statistical Institute Calcutta, India.
VANCE, C. P., M. A. EGLI, S. M. GRIFFITH & S. S. MILLER, 1988: Plant regulated aspects of nodulation on N2-fixation. Plant Cell Env. 11, 413-427.
WERNER, D., 1980: Stickstoff (N2-Fixierung und Produktionsbiologie). Angew. Botanik 54, 67-75.
WERNER, D., 1987: Pflanzliche und mikrobielle Symbiosen. Verlag Georg Thieme, Stuttgart.
WERNER, D., 1992: Physiology of nitrogen fixing legume noduls: Compartment and functions. In: STACY G., H. J. EVANS & R. H. BURRIS (eds.): Biological nitrogen fixation. Verlag Chapman and Hall, London.
